La cachessia è una malattia sistemica caratterizzata da perdita di peso, atrofia muscolare e del tessuto adiposo e infiammazione sistemica. La cachessia è una delle principali complicanze e cause di morte nei pazienti oncologici. Oltre al cancro, la cachessia può essere causata da una varietà di malattie croniche non maligne, tra cui insufficienza cardiaca, insufficienza renale, broncopneumopatia cronica ostruttiva, malattie neurologiche, AIDS e artrite reumatoide. Si stima che l'incidenza della cachessia nei pazienti oncologici possa raggiungere il 25-70%, il che influisce gravemente sulla qualità della vita (QOL) dei pazienti e aggrava la tossicità correlata al trattamento.
Un intervento efficace contro la cachessia è di grande importanza per migliorare la qualità della vita e la prognosi dei pazienti oncologici. Tuttavia, nonostante alcuni progressi nello studio dei meccanismi fisiopatologici della cachessia, molti farmaci sviluppati sulla base di possibili meccanismi sono solo parzialmente efficaci o inefficaci. Attualmente non esiste un trattamento efficace approvato dalla Food and Drug Administration (FDA) statunitense.
Sono molteplici le ragioni del fallimento degli studi clinici sulla cachessia, e la ragione fondamentale potrebbe risiedere nella mancanza di una comprensione approfondita del meccanismo e del decorso naturale della cachessia. Recentemente, il professor Xiao Ruiping e il ricercatore Hu Xinli del College of Future Technology dell'Università di Pechino hanno pubblicato congiuntamente un articolo su Nature Metabolism, rivelando l'importante ruolo del pathway lattico-GPR81 nell'insorgenza della cachessia tumorale, fornendo una nuova idea per il trattamento della cachessia. Riassumiamo questo articolo sintetizzando articoli di Nat Metab, Science, Nat Rev Clin Oncol e altre riviste.
La perdita di peso è solitamente causata da una riduzione dell'assunzione di cibo e/o da un aumento del dispendio energetico. Studi precedenti hanno suggerito che questi cambiamenti fisiologici nella cachessia associata al tumore siano indotti da alcune citochine secrete dal microambiente tumorale. Ad esempio, fattori come il fattore di crescita e differenziazione 15 (GDF15), la lipocalina-2 e la proteina insulino-simile 3 (INSL3) possono inibire l'assunzione di cibo legandosi ai siti regolatori dell'appetito nel sistema nervoso centrale, causando anoressia nei pazienti. IL-6, PTHrP, activina A e altri fattori inducono la perdita di peso e l'atrofia tissutale attivando la via catabolica e aumentando il dispendio energetico. Attualmente, la ricerca sul meccanismo della cachessia si è concentrata principalmente su queste proteine secrete e pochi studi hanno coinvolto l'associazione tra metaboliti tumorali e cachessia. Il professor Xiao Ruiping e il ricercatore Hu Xinli hanno adottato un nuovo approccio per svelare l'importante meccanismo della cachessia correlata al tumore dal punto di vista dei metaboliti tumorali.
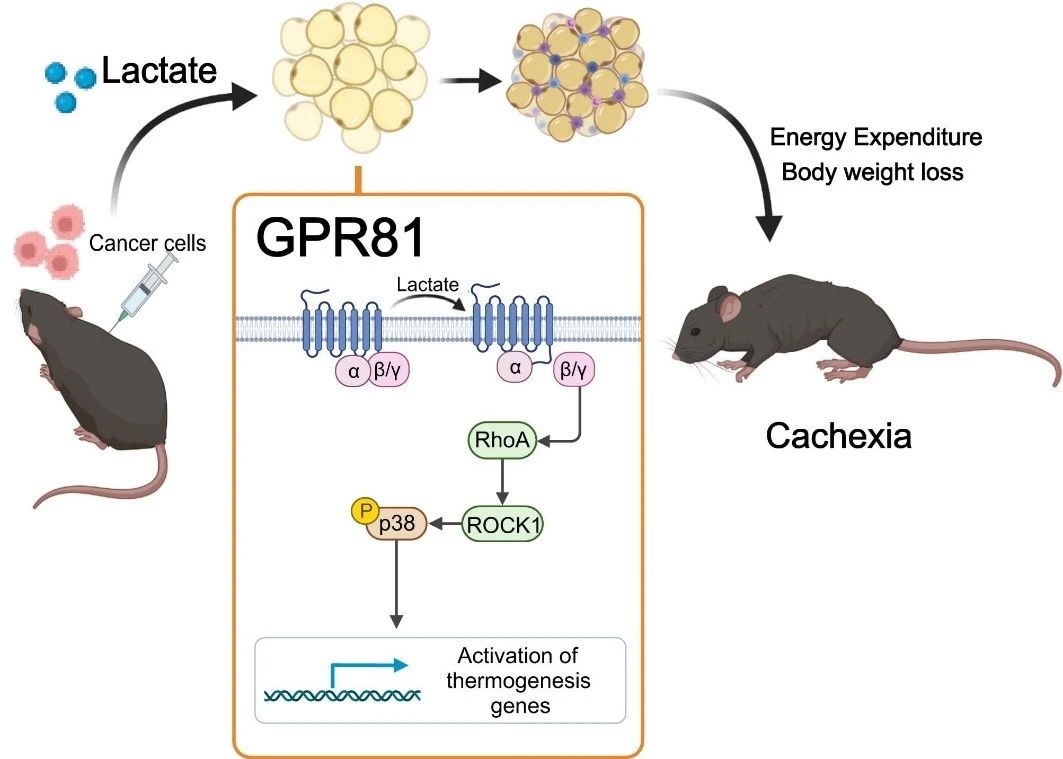
In primo luogo, il team del Professor Xiao Ruiping ha analizzato migliaia di metaboliti nel sangue di soggetti sani e di topi modello di cachessia da cancro al polmone, scoprendo che l'acido lattico era il metabolita più significativamente elevato nei topi con cachessia. Il livello sierico di acido lattico aumentava con la crescita del tumore e mostrava una forte correlazione con la variazione di peso dei topi affetti da tumore. Campioni di siero raccolti da pazienti affetti da cancro al polmone confermano che l'acido lattico svolge anche un ruolo chiave nella progressione della cachessia tumorale umana.
Per determinare se alti livelli di acido lattico causassero cachessia, il team di ricerca ha iniettato acido lattico nel sangue di topi sani attraverso una pompa osmotica impiantata sotto la pelle, aumentando artificialmente i livelli sierici di acido lattico fino a raggiungere quelli dei topi con cachessia. Dopo 2 settimane, i topi hanno sviluppato un fenotipo tipico della cachessia, con perdita di peso, atrofia del tessuto adiposo e muscolare. Questi risultati suggeriscono che il rimodellamento del tessuto adiposo indotto dal lattato è simile a quello indotto dalle cellule tumorali. Il lattato non è solo un metabolita caratteristico della cachessia tumorale, ma anche un mediatore chiave del fenotipo ipercatabolico indotto dal cancro.
Successivamente, hanno scoperto che la delezione del recettore del lattato GPR81 era efficace nell'alleviare le manifestazioni di cachessia indotta dal tumore e dal lattato sierico, senza influenzare i livelli sierici di lattato. Poiché GPR81 è altamente espresso nel tessuto adiposo e si modifica nel tessuto adiposo prima del muscolo scheletrico durante lo sviluppo della cachessia, l'effetto knockout specifico di GPR81 nel tessuto adiposo del topo è simile a quello del knockout sistemico, migliorando la perdita di peso indotta dal tumore e il consumo di grasso e muscolo scheletrico. Ciò suggerisce che GPR81 nel tessuto adiposo sia necessario per lo sviluppo della cachessia tumorale indotta dall'acido lattico.
Ulteriori studi hanno confermato che dopo il legame con GPR81, le molecole di acido lattico determinano l'imbrunimento dei grassi, la lipolisi e un aumento della produzione di calore sistemico attraverso il percorso di segnalazione Gβγ-RhoA/ROCK1-p38, anziché attraverso il classico percorso PKA.
Nonostante i risultati promettenti nella patogenesi della cachessia correlata al cancro, questi risultati non si sono ancora tradotti in trattamenti efficaci, quindi attualmente non esistono standard di trattamento per questi pazienti, ma alcune società, come l'ESMO e la Società Europea di Nutrizione Clinica e Metabolismo, hanno sviluppato linee guida cliniche. Attualmente, le linee guida internazionali raccomandano fortemente di promuovere il metabolismo e ridurre il catabolismo attraverso approcci come nutrizione, esercizio fisico e farmaci.
Data di pubblicazione: 28-04-2024