Il trapianto di polmone è il trattamento accettato per le malattie polmonari avanzate. Negli ultimi decenni, il trapianto di polmone ha compiuto notevoli progressi nello screening e nella valutazione dei riceventi, nella selezione, conservazione e assegnazione dei polmoni del donatore, nelle tecniche chirurgiche, nella gestione postoperatoria, nella gestione delle complicanze e nell'immunosoppressione.
In oltre 60 anni, il trapianto di polmone si è evoluto da trattamento sperimentale a trattamento standard accettato per le malattie polmonari potenzialmente letali. Nonostante problemi comuni come la disfunzione primaria del trapianto, la disfunzione polmonare cronica da trapianto (CLAD), l'aumento del rischio di infezioni opportunistiche, cancro e problemi di salute cronici correlati all'immunosoppressione, vi sono promesse di migliorare la sopravvivenza e la qualità della vita dei pazienti attraverso la selezione del ricevente giusto. Sebbene i trapianti di polmone stiano diventando più comuni in tutto il mondo, il numero di interventi non è ancora al passo con la crescente domanda. Questa revisione si concentra sullo stato attuale e sui recenti progressi nel trapianto di polmone, nonché sulle future opportunità per l'implementazione efficace di questa terapia impegnativa ma potenzialmente in grado di cambiare la vita.
Valutazione e selezione dei potenziali destinatari
Poiché i polmoni dei donatori idonei sono relativamente scarsi, i centri trapianti sono eticamente tenuti ad assegnare gli organi dei donatori ai potenziali riceventi che hanno maggiori probabilità di trarre un beneficio netto dal trapianto. La definizione tradizionale di tali potenziali riceventi è che hanno un rischio stimato superiore al 50% di morire di malattia polmonare entro 2 anni e una probabilità superiore all'80% di sopravvivere 5 anni dopo il trapianto, supponendo che i polmoni trapiantati siano pienamente funzionali. Le indicazioni più comuni per il trapianto di polmone sono la fibrosi polmonare, la broncopneumopatia cronica ostruttiva, la malattia vascolare polmonare e la fibrosi cistica. I pazienti vengono indirizzati al trapianto in base alla riduzione della funzionalità polmonare, alla riduzione della funzionalità fisica e alla progressione della malattia nonostante l'uso massimo di farmaci e terapie chirurgiche; vengono considerati anche altri criteri specifici della malattia. Le sfide prognostiche supportano strategie di indirizzamento precoce che consentono una migliore consulenza rischio-beneficio per migliorare il processo decisionale condiviso e l'opportunità di modificare i potenziali ostacoli al successo del trapianto. Il team multidisciplinare valuterà la necessità di un trapianto di polmone e il rischio di complicanze post-trapianto del paziente dovute all'uso di immunosoppressori, come il rischio di infezioni potenzialmente letali. Lo screening per la disfunzione d'organo extrapolmonare, la forma fisica, la salute mentale, l'immunità sistemica e il cancro è fondamentale. Valutazioni specifiche delle arterie coronarie e cerebrali, della funzionalità renale, della salute delle ossa, della funzionalità esofagea, della capacità psicosociale e del supporto sociale sono fondamentali, mentre si presta attenzione a mantenere la trasparenza per evitare disuguaglianze nella determinazione dell'idoneità al trapianto.
I fattori di rischio multipli sono più dannosi dei fattori di rischio singoli. Tra i tradizionali ostacoli al trapianto figurano l'età avanzata, l'obesità, una storia di cancro, malattie gravi e malattie sistemiche concomitanti, ma questi fattori sono stati recentemente messi in discussione. L'età dei riceventi è in costante aumento ed entro il 2021 il 34% dei riceventi negli Stati Uniti avrà più di 65 anni, il che indica una crescente enfasi sull'età biologica rispetto a quella cronologica. Ora, oltre alla distanza percorsa a piedi in sei minuti, viene spesso utilizzata una valutazione più formale della fragilità, incentrata sulle riserve fisiche e sulle risposte attese agli stress. La fragilità è associata a scarsi esiti dopo il trapianto di polmone e, di solito, alla composizione corporea. I metodi per calcolare l'obesità e la composizione corporea continuano a evolversi, concentrandosi meno sull'IMC e più sul contenuto di grasso e sulla massa muscolare. Sono in fase di sviluppo strumenti che promettono di quantificare sbandamento, oligomiosi e resilienza per prevedere meglio la capacità di recupero dopo il trapianto di polmone. Grazie alla riabilitazione polmonare preoperatoria è possibile modificare la composizione corporea e la debilitazione, migliorando così i risultati.
In caso di patologie acute critiche, determinare l'entità della debilitazione e la capacità di recupero è particolarmente impegnativo. I trapianti in pazienti sottoposti a ventilazione meccanica erano in precedenza rari, ma ora stanno diventando più comuni. Inoltre, negli ultimi anni è aumentato l'uso del supporto vitale extracorporeo come trattamento transitorio pre-trapianto. I progressi nella tecnologia e nell'accesso vascolare hanno reso possibile per i pazienti coscienti, accuratamente selezionati e sottoposti a supporto vitale extracorporeo, partecipare alle procedure di consenso informato e alla riabilitazione fisica, e ottenere risultati dopo il trapianto simili a quelli dei pazienti che non necessitavano di supporto vitale extracorporeo prima del trapianto.
La presenza di una malattia sistemica concomitante era precedentemente considerata una controindicazione assoluta, ma il suo impatto sugli esiti post-trapianto deve ora essere valutato in modo specifico. Dato che l'immunosoppressione correlata al trapianto aumenta la probabilità di recidiva tumorale, le precedenti linee guida sulle neoplasie preesistenti sottolineavano il requisito che i pazienti non presentassero cancro da cinque anni prima di essere inseriti nella lista d'attesa per il trapianto. Tuttavia, con la crescente efficacia delle terapie oncologiche, si raccomanda ora di valutare la probabilità di recidiva tumorale su base individuale per ogni paziente. La malattia autoimmune sistemica è stata tradizionalmente considerata una controindicazione, un'opinione problematica perché la malattia polmonare avanzata tende a limitare l'aspettativa di vita di questi pazienti. Le nuove linee guida raccomandano che il trapianto di polmone sia preceduto da una valutazione e un trattamento più mirati della malattia per ridurre le manifestazioni che possono influire negativamente sugli esiti, come i problemi esofagei associati alla sclerodermia.
Gli anticorpi circolanti contro specifiche sottoclassi HLA possono rendere alcuni potenziali riceventi allergici a specifici organi del donatore, con conseguenti tempi di attesa più lunghi, ridotta probabilità di trapianto, rigetto acuto dell'organo e rischio elevato di CLAD. Tuttavia, alcuni trapianti tra anticorpi del ricevente candidato e tipi di donatore hanno ottenuto risultati simili con regimi di desensibilizzazione preoperatoria, tra cui plasmaferesi, immunoglobuline per via endovenosa e terapia anti-cellule B.
Selezione e applicazione del polmone del donatore
La donazione di organi è un atto altruistico. Ottenere il consenso del donatore e rispettarne l'autonomia sono i fattori etici più importanti. I polmoni del donatore possono essere danneggiati da traumi toracici, rianimazione cardiopolmonare (RCP), aspirazione, embolia, lesioni o infezioni correlate alla ventilazione meccanica o lesioni neurogene, pertanto molti polmoni del donatore non sono idonei al trapianto. ISHLT (Società Internazionale per il Trapianto di Cuore e Polmoni)
Il trapianto di polmone definisce criteri di donazione generalmente accettati, che variano da centro trapianti a centro trapianti. Infatti, pochissimi donatori soddisfano i criteri "ideali" per la donazione di polmone (Figura 2). Un maggiore utilizzo di polmoni da donatore è stato ottenuto attraverso l'allentamento dei criteri di donazione (ovvero, donatori che non soddisfano gli standard ideali convenzionali), un'attenta valutazione, l'assistenza attiva al donatore e la valutazione in vitro (Figura 2). Una storia di fumo attivo da parte del donatore è un fattore di rischio per la disfunzione primaria del trapianto nel ricevente, ma il rischio di morte derivante dall'uso di tali organi è limitato e dovrebbe essere valutato rispetto alle conseguenze sulla mortalità di una lunga attesa per un polmone da donatore da un non fumatore. L'uso di polmoni da donatori più anziani (oltre i 70 anni) rigorosamente selezionati e privi di altri fattori di rischio può raggiungere risultati di sopravvivenza e funzionalità polmonare del ricevente simili a quelli di donatori più giovani.
Un'adeguata cura per più donatori di organi e la valutazione di una possibile donazione di polmoni sono essenziali per garantire che i polmoni del donatore abbiano un'elevata probabilità di essere idonei al trapianto. Sebbene pochi dei polmoni attualmente forniti soddisfino la definizione tradizionale di polmone ideale per il donatore, un allentamento dei criteri oltre questi potrebbe portare a un utilizzo efficace degli organi senza compromettere i risultati. Metodi standardizzati di conservazione dei polmoni contribuiscono a proteggere l'integrità dell'organo prima del suo impianto nel ricevente. Gli organi possono essere trasportati presso le strutture di trapianto in diverse condizioni, come la conservazione criostatica o la perfusione meccanica in ipotermia o a temperatura corporea normale. I polmoni che non sono considerati idonei al trapianto immediato possono essere ulteriormente valutati oggettivamente e trattati con perfusione polmonare in vitro (EVLP) o conservati per periodi di tempo più lunghi per superare le barriere organizzative al trapianto. Il tipo di trapianto polmonare, la procedura e il supporto intraoperatorio dipendono dalle esigenze del paziente e dall'esperienza e dalle preferenze del chirurgo. Per i potenziali riceventi di trapianto polmonare la cui malattia peggiora drasticamente in attesa del trapianto, il supporto vitale extracorporeo può essere preso in considerazione come trattamento transitorio pre-trapianto. Le complicanze postoperatorie precoci possono includere sanguinamento, ostruzione delle vie aeree o anastomosi vascolare e infezione della ferita. Il danno al nervo frenico o vago nel torace può portare ad altre complicanze, che influenzano rispettivamente la funzionalità del diaframma e lo svuotamento gastrico. Il polmone del donatore può presentare un danno polmonare acuto precoce dopo l'impianto e la riperfusione, ovvero una disfunzione primaria del trapianto. È importante classificare e trattare la gravità della disfunzione primaria del trapianto, che è associata a un alto rischio di morte precoce. Poiché il potenziale danno polmonare del donatore si verifica entro poche ore dalla lesione cerebrale iniziale, la gestione polmonare deve includere impostazioni di ventilazione adeguate, riespansione alveolare, broncoscopia, aspirazione e lavaggio (per le colture di campionamento), gestione dei fluidi del paziente e aggiustamento della posizione del torace. ABO sta per gruppo sanguigno A, B, AB e 0, CVP sta per pressione venosa centrale, DCD sta per donatore di polmone da morte cardiaca, ECMO sta per ossigenazione extracorporea a membrana, EVLW sta per acqua polmonare extravascolare, PaO2/FiO2 sta per rapporto tra pressione parziale di ossigeno arterioso e concentrazione di ossigeno inalato e PEEP sta per pressione positiva di fine espirazione. PiCCO rappresenta la gittata cardiaca della forma d'onda dell'indice di polso.
In alcuni Paesi, l'uso di polmoni da donatore controllato (DCD) è aumentato al 30-40% nei pazienti con morte cardiaca, e sono stati raggiunti tassi simili di rigetto acuto d'organo, CLAD e sopravvivenza. Tradizionalmente, gli organi provenienti da donatori infetti da virus infettivi dovrebbero essere evitati per il trapianto in riceventi non infetti; negli ultimi anni, tuttavia, i farmaci antivirali che agiscono direttamente contro il virus dell'epatite C (HCV) hanno permesso di trapiantare in sicurezza polmoni da donatori HCV-positivi in riceventi HCV-negativi. Analogamente, i polmoni da donatori positivi al virus dell'immunodeficienza umana (HIV) possono essere trapiantati in riceventi HIV-positivi, e i polmoni da donatori positivi al virus dell'epatite B (HBV) possono essere trapiantati in riceventi vaccinati contro l'HBV e immuni. Sono stati segnalati casi di trapianti di polmoni da donatori infetti da SARS-CoV-2 attivi o pregressi. Sono necessarie ulteriori prove per determinare la sicurezza dell'infezione dei polmoni dei donatori con virus infettivi per il trapianto.
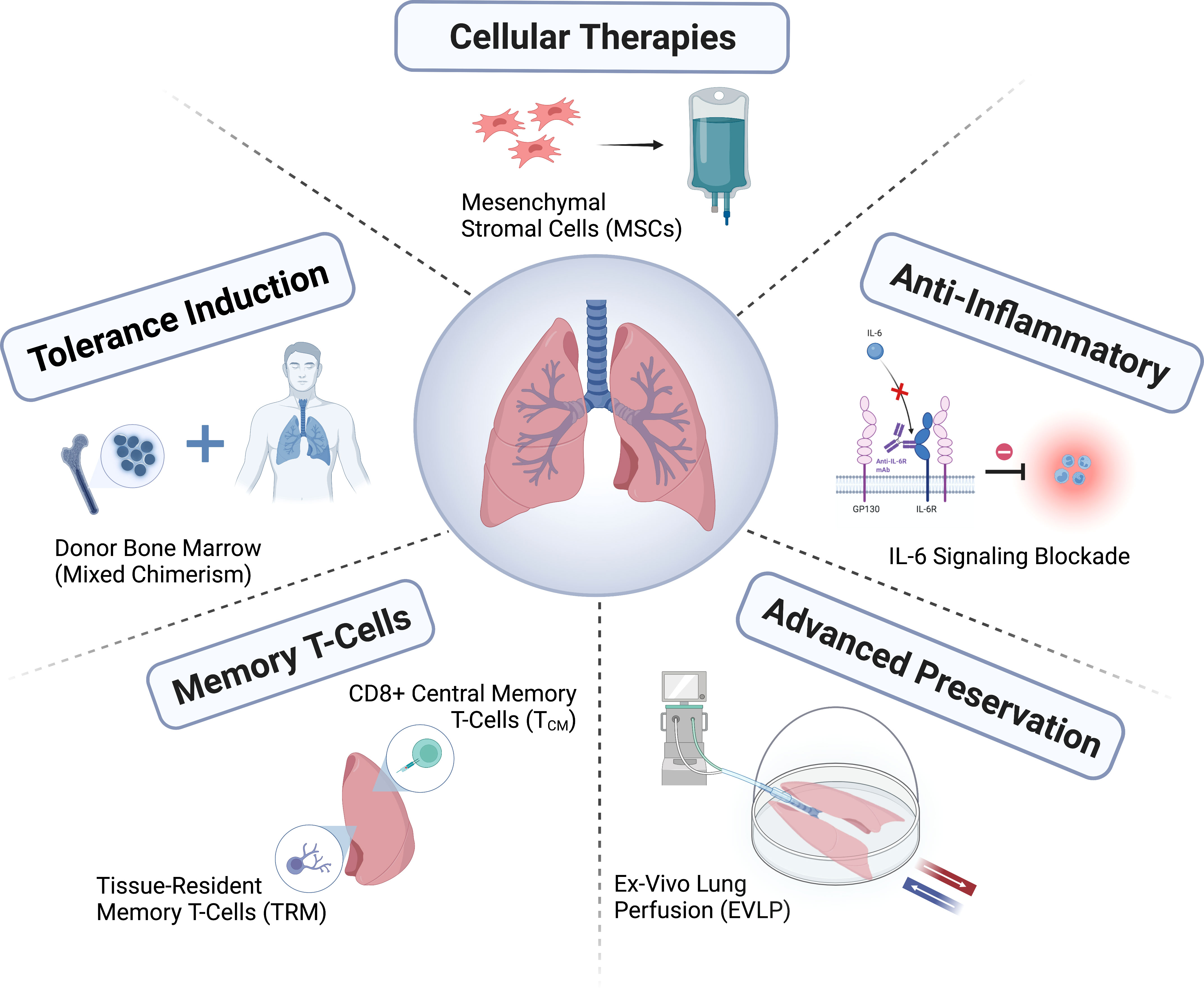
A causa della complessità del prelievo di organi multipli, è difficile valutare la qualità dei polmoni del donatore. L'utilizzo di un sistema di perfusione polmonare in vitro per la valutazione consente una valutazione più dettagliata della funzionalità polmonare del donatore e della possibilità di ripararla prima dell'uso (Figura 2). Poiché il polmone del donatore è altamente suscettibile a lesioni, il sistema di perfusione polmonare in vitro fornisce una piattaforma per la somministrazione di terapie biologiche specifiche per riparare il polmone del donatore danneggiato (Figura 2). Due studi randomizzati hanno dimostrato che la perfusione polmonare in vitro a temperatura corporea normale di polmoni di donatori che soddisfano i criteri convenzionali è sicura e che il team di trapianto può prolungare il tempo di conservazione in questo modo. È stato riportato che la conservazione dei polmoni del donatore a una temperatura più elevata (da 6 a 10 °C) anziché a 0-4 °C in ghiaccio migliora la salute mitocondriale, riduce il danno e migliora la funzionalità polmonare. Per i trapianti semi-selettivi giornalieri, è stato riportato che una conservazione notturna più lunga consente di ottenere buoni risultati post-trapianto. È attualmente in corso un ampio studio di sicurezza non inferiore che confronta la conservazione a 10 °C con la crioconservazione standard (numero di registrazione NCT05898776 su ClinicalTrials.gov). Si sta sempre più promuovendo il recupero tempestivo degli organi attraverso centri di cura multiorgano e il miglioramento della funzionalità degli organi attraverso centri di riparazione, in modo che organi di migliore qualità possano essere utilizzati per il trapianto. L'impatto di questi cambiamenti nell'ecosistema dei trapianti è ancora in fase di valutazione.
Al fine di preservare gli organi DCD controllabili, la perfusione locale a temperatura corporea normale in situ tramite ossigenazione extracorporea a membrana (ECMO) può essere utilizzata per valutare la funzionalità degli organi addominali e supportare l'acquisizione diretta e la conservazione degli organi toracici, compresi i polmoni. L'esperienza con il trapianto di polmone dopo perfusione locale a temperatura corporea normale nel torace e nell'addome è limitata e i risultati sono contrastanti. Si teme che questa procedura possa causare danni ai donatori deceduti e violare i principi etici fondamentali del prelievo di organi; pertanto, la perfusione locale a temperatura corporea normale non è ancora consentita in molti Paesi.
Cancro
L'incidenza di cancro nella popolazione dopo trapianto di polmone è più elevata rispetto alla popolazione generale e la prognosi tende a essere sfavorevole, rappresentando il 17% dei decessi. Il cancro al polmone e la malattia linfoproliferativa post-trapianto (PTLD) sono le cause più comuni di morte correlata al cancro. L'immunosoppressione a lungo termine, gli effetti del fumo pregresso o il rischio di una malattia polmonare sottostante aumentano il rischio di sviluppare un cancro al polmone nel polmone di un singolo ricevente, ma in rari casi, il cancro al polmone subclinico trasmesso dal donatore può verificarsi anche nei polmoni trapiantati. Il cancro della pelle non melanoma è il tumore più comune tra i riceventi di trapianto, quindi è essenziale un monitoraggio regolare del cancro della pelle. La PTLD delle cellule B causata dal virus di Epstein-Barr è un'importante causa di malattia e morte. Sebbene la PTLD possa risolversi con un'immunosoppressione minima, di solito è necessaria una terapia mirata alle cellule B con rituximab, chemioterapia sistemica o entrambe.
Sopravvivenza e risultati a lungo termine
La sopravvivenza dopo il trapianto di polmone rimane limitata rispetto ad altri trapianti di organi, con una mediana di 6,7 anni, e sono stati compiuti pochi progressi negli esiti a lungo termine per i pazienti nell'arco di tre decenni. Tuttavia, molti pazienti hanno riscontrato miglioramenti significativi nella qualità della vita, nello stato fisico e in altri esiti riferiti dai pazienti; per condurre una valutazione più completa degli effetti terapeutici del trapianto di polmone, è necessario prestare maggiore attenzione agli esiti riferiti da questi pazienti. Un'importante esigenza clinica insoddisfatta è quella di affrontare la mortalità del ricevente dovuta a complicanze fatali dovute a fallimento tardivo del trapianto o a immunosoppressione prolungata. Per i riceventi di trapianto di polmone, è necessario fornire un'assistenza attiva a lungo termine, che richiede un lavoro di squadra per proteggere la salute generale del ricevente monitorando e mantenendo la funzionalità del trapianto da un lato, riducendo al minimo gli effetti avversi dell'immunosoppressione e supportando la salute fisica e mentale del ricevente dall'altro (Figura 1).
Direzione futura
Il trapianto di polmone è un trattamento che ha fatto molta strada in breve tempo, ma deve ancora esprimere il suo pieno potenziale. La carenza di polmoni da donatori idonei rimane una sfida importante e sono ancora in fase di sviluppo nuovi metodi per la valutazione e la cura dei donatori, il trattamento e la riparazione dei polmoni dei donatori e il miglioramento della conservazione dei donatori. È necessario migliorare le politiche di allocazione degli organi migliorando la compatibilità tra donatori e riceventi per aumentare ulteriormente i benefici netti. Vi è un crescente interesse nella diagnosi di rigetto o infezione attraverso la diagnostica molecolare, in particolare con DNA libero derivato dal donatore, o nel guidare la minimizzazione dell'immunosoppressione; tuttavia, l'utilità di queste diagnosi come complemento agli attuali metodi clinici di monitoraggio del trapianto resta da determinare.
Il campo del trapianto polmonare si è sviluppato attraverso la formazione di consorzi (ad esempio, ClinicalTrials.gov numero di registrazione NCT04787822; https://lungtransplantconsortium.org). La collaborazione contribuirà alla prevenzione e al trattamento della disfunzione primaria del trapianto, alla previsione del CLAD, alla diagnosi precoce e ai punti interni (endotipizzazione), alla sindrome di raffinamento. Sono stati compiuti progressi più rapidi nello studio della disfunzione primaria del trapianto, del rigetto mediato da anticorpi e dei meccanismi ALAD e CLAD. Ridurre al minimo gli effetti collaterali e il rischio di ALAD e CLAD attraverso una terapia immunosoppressiva personalizzata, nonché definire esiti incentrati sul paziente e incorporarli nelle misure di esito, sarà fondamentale per migliorare il successo a lungo termine del trapianto polmonare.
Data di pubblicazione: 23-11-2024