Per le donne in età riproduttiva affette da epilessia, la sicurezza dei farmaci antiepilettici è fondamentale per loro e per la loro prole, poiché spesso è necessario assumere farmaci durante la gravidanza e l'allattamento per ridurre gli effetti delle crisi. È preoccupante se lo sviluppo degli organi fetali sia influenzato dal trattamento farmacologico antiepilettico materno durante la gravidanza. Studi precedenti hanno suggerito che, tra i farmaci antiepilettici tradizionali, l'acido valproico, il fenobarbital e la carbamazepina possono presentare rischi teratogeni. Tra i nuovi farmaci antiepilettici, la lamotrigina è considerata relativamente sicura per il feto, mentre il topiramato può aumentare il rischio di labiopalatoschisi fetale.
Diversi studi sullo sviluppo neurologico hanno dimostrato un'associazione tra l'uso materno di acido valproico durante la gravidanza e la riduzione delle funzioni cognitive, l'autismo e il disturbo da deficit di attenzione e iperattività (ADHD) nella prole. Tuttavia, le prove di alta qualità sulla relazione tra l'uso materno di topiramato durante la gravidanza e lo sviluppo neurologico della prole rimangono insufficienti. Fortunatamente, un nuovo studio pubblicato la scorsa settimana sul New England Journal of Medicine (NEJM) ci fornisce ulteriori prove.
Nel mondo reale, non sono possibili studi clinici randomizzati e controllati su larga scala su donne in gravidanza affette da epilessia che necessitano di farmaci anticonvulsivanti per valutarne la sicurezza. Di conseguenza, registri di gravidanza, studi di coorte e studi caso-controllo sono diventati i disegni di studio più comunemente utilizzati. Da un punto di vista metodologico, questo studio è uno degli studi di alta qualità attualmente implementabili. I suoi punti salienti sono i seguenti: è stato adottato il metodo di studio di coorte su ampio campione basato sulla popolazione. Sebbene il disegno sia retrospettivo, i dati provengono da due grandi database nazionali dei sistemi Medicaid e Medicare statunitensi che sono stati precedentemente arruolati, quindi l'affidabilità dei dati è elevata; il tempo mediano di follow-up è stato di 2 anni, che ha sostanzialmente soddisfatto il tempo necessario per la diagnosi di autismo, e quasi il 10% (oltre 400.000 casi in totale) è stato seguito per più di 8 anni.
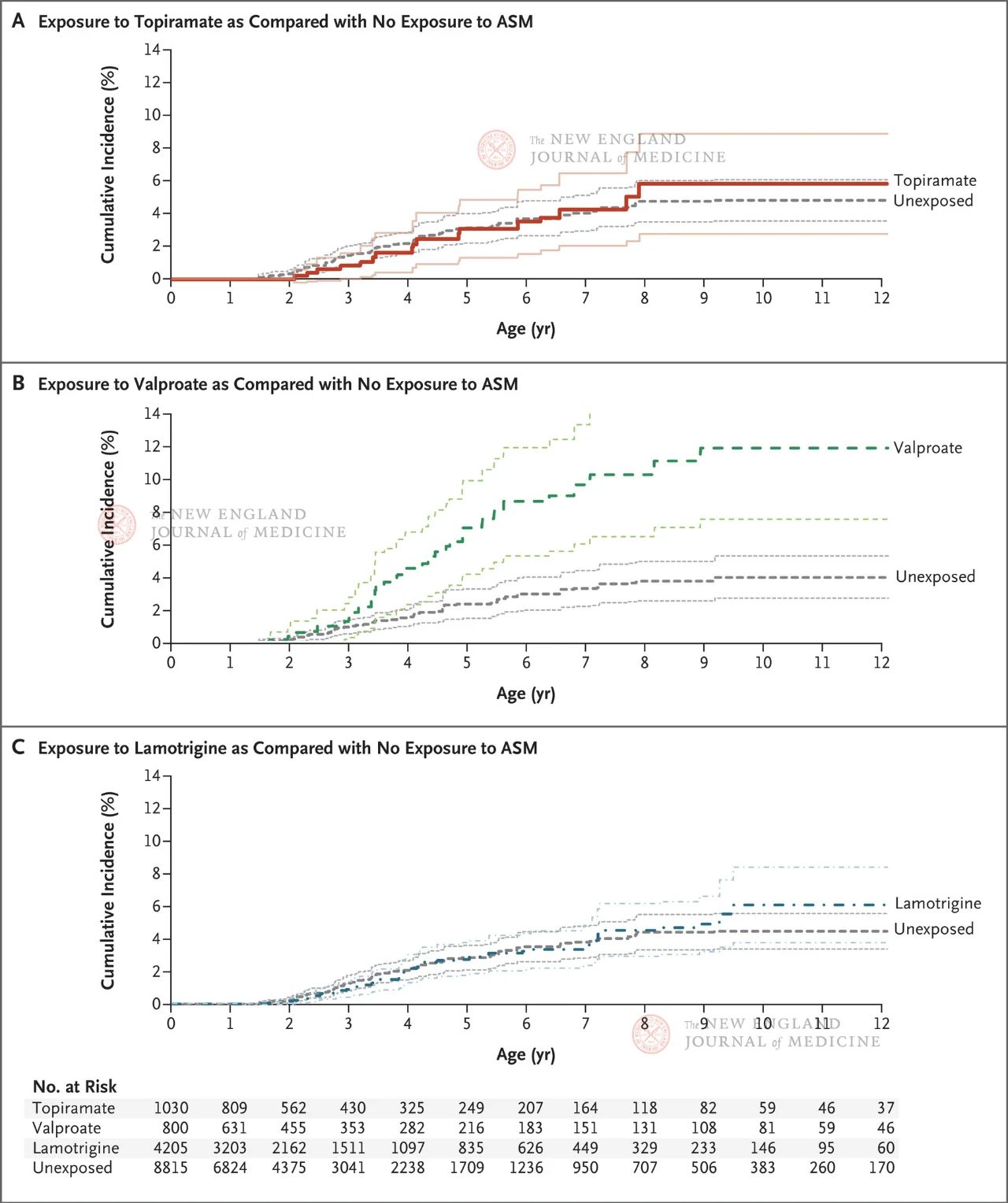
Lo studio ha incluso oltre 4 milioni di donne in gravidanza idonee, 28.952 delle quali avevano ricevuto una diagnosi di epilessia. Le donne sono state raggruppate in base all'assunzione di farmaci antiepilettici o di altri farmaci antiepilettici dopo la 19a settimana di gestazione (fase in cui le sinapsi continuano a formarsi). Il topiramato era nel gruppo esposto, l'acido valproico nel gruppo di controllo positivo e la lamotrigina nel gruppo di controllo negativo. Il gruppo di controllo non esposto includeva tutte le donne in gravidanza che non assumevano alcun farmaco antiepilettico da 90 giorni prima dell'ultima mestruazione fino al momento del parto (incluse anche le donne con epilessia inattiva o non trattata).
I risultati hanno mostrato che l'incidenza cumulativa stimata di autismo all'età di 8 anni era dell'1,89% tra tutta la prole non esposta ad alcun farmaco antiepilettico; tra i figli nati da madri epilettiche, l'incidenza cumulativa di autismo era del 4,21% (IC 95%, 3,27-5,16) nei bambini che non erano esposti a farmaci antiepilettici. L'incidenza cumulativa di autismo nella prole esposta a topiramato, valproato o lamotrigina era rispettivamente del 6,15% (IC 95%, 2,98-9,13), 10,51% (IC 95%, 6,78-14,24) e 4,08% (IC 95%, 2,75-5,41).
Rispetto ai feti non esposti a farmaci anticonvulsivanti, il rischio di autismo aggiustato per i punteggi di propensione era il seguente: 0,96 (95%CI, 0,56~1,65) nel gruppo esposto a topiramato, 2,67 (95%CI, 1,69~4,20) nel gruppo esposto ad acido valproico e 1,00 (95%CI, 0,69~1,46) nel gruppo esposto a lamotrigina. In un'analisi di sottogruppo, gli autori hanno tratto conclusioni simili in base alla monoterapia o meno dei pazienti, alla dose di terapia farmacologica e all'eventuale esposizione correlata al farmaco nelle prime fasi della gravidanza.
I risultati hanno mostrato che la prole di donne in gravidanza affette da epilessia presentava un rischio più elevato di autismo (4,21%). Né il topiramato né la lamotrigina hanno aumentato il rischio di autismo nella prole di madri che assumevano farmaci anticonvulsivanti durante la gravidanza; tuttavia, quando l'acido valproico veniva assunto durante la gravidanza, si è verificato un aumento del rischio di autismo dose-dipendente nella prole. Sebbene lo studio si sia concentrato esclusivamente sull'incidenza di autismo nella prole di donne in gravidanza che assumevano farmaci anticonvulsivanti e non abbia preso in considerazione altri comuni esiti neuroevolutivi come il declino cognitivo nella prole e l'ADHD, riflette comunque la neurotossicità relativamente debole del topiramato nella prole rispetto al valproato.
Il topiramato non è generalmente considerato un sostituto favorevole del valproato di sodio durante la gravidanza, poiché può aumentare il rischio di labiopalatoschisi e di feci piccole per l'età gestazionale. Inoltre, studi suggeriscono che il topiramato possa aumentare il rischio di disturbi dello sviluppo neurologico nella prole. Tuttavia, lo studio del NEJM dimostra che, se si considera solo l'effetto sullo sviluppo neurologico della prole, per le donne in gravidanza che necessitano di utilizzare il valproato per le crisi epilettiche, è necessario aumentare il rischio di disturbi dello sviluppo neurologico nella prole. Il topiramato può essere utilizzato come medicina alternativa. Va notato che la percentuale di asiatici e di altre isole del Pacifico nell'intera coorte è molto bassa, rappresentando solo l'1% dell'intera coorte, e potrebbero esserci differenze razziali nelle reazioni avverse ai farmaci antiepilettici, pertanto se i risultati di questo studio possano essere estesi direttamente alle popolazioni asiatiche (inclusi i cinesi) deve essere confermato da ulteriori risultati di ricerca sulle popolazioni asiatiche in futuro.
Data di pubblicazione: 30-03-2024